Pembuatan Koloid – Sistem koloid adalah antara solusi nyata dan suspensi. Karena itu susu adalah koloid yang terletak di antara larutan gula (larutan nyata) dan campuran air dengan pasir (suspensi).
Oleh karena itu, sistem koloid dapat dibuat dari solusi dan suspensi nyata. Koloid larutan nyata dibuat dengan kondensasi.
Anda melakukan ini dengan menggabungkan partikel dalam larutan nyata menjadi partikel koloid.
Pengertian Koloid

Koloid adalah campuran heterogen dari dua atau lebih zat di mana partikel-partikel dari satu zat antara 1 dan 1000 nm tersebar secara merata (didistribusikan) dalam medium zat lain.
Zat yang didispersikan sebagai partikel disebut sebagai fase terdispersi, sedangkan zat yang menjadi partikel terdispersi disebut sebagai media pendispersi.
Sementara itu, koloid dibuat dari suspensi dengan dispersi. Anda melakukan ini dengan menghaluskan partikel suspensi hingga seukuran partikel koloid dan mendispersikannya dalam media pendispersi.
Secara makroskopis, koloid tampak seperti larutan di mana campuran zat terlarut dan pelarut yang homogen terbentuk.
Namun secara mikroskopis, itu tampak seperti suspensi, yang merupakan campuran heterogen, di mana setiap komponen campuran cenderung terpisah.
Metode Kondensasi

Pembuatan Koloid
Produksi koloid dengan kondensasi dapat dibagi menjadi dua area, yaitu metode kimia dan fisika. Kedua metode ini banyak digunakan untuk membuat koloid jenis sol, terutama sol emas dan sol sulfur.
Cara Kimia
Produksi koloid dari larutan nyata melalui reaksi kimia dapat dilakukan dengan empat cara, yaitu dengan pengendapan, hidrolisis, reaksi transfer dan reaksi redoks.
Reaksi sedimentasi
Produksi koloid melalui reaksi deposisi terjadi dengan mencampur dua jenis larutan elektrolit untuk menghasilkan sedimen dengan ukuran koloid, misalnya dengan memproduksi sol AgCl.
Sol AgCl dibuat dengan mencampurkan larutan AgNO 3 encer dengan larutan HCl atau NaCl encer. Reaksinya adalah sebagai berikut.
- AgNO 3 (aq) + HCl (aq) → AgCl (s) + HNO 3 (aq)
- AgNO 3 (aq) + NaCl (aq) AgCl (s) + NaNO 3 (aq)
Reaksi hidrolisis
Koloid dapat dihasilkan oleh reaksi hidrolisis, yaitu dengan mereaksikan garam tertentu dengan air.
Misalnya Sol Fe (OH) 3. Sol Fe (OH) 3 dibuat dengan menambahkan larutan FeCl 3 ke air mendidih. Solusi FeCl3 terionisasi untuk membentuk ion Fe3 +. Ion Fe3 + ini mengalami reaksi hidrolisis menjadi Fe (OH) 3. Reaksi yang terjadi:
FeCl 3 (aq) + 3H20 (ℓ) → Fe (OH) a (s) + 3HCl (aq).
Reaksi transfer / substitusi
Contoh koloid yang dibuat dengan transfer adalah sol As2S3. Sol As2S3 dibuat dengan mengalirkan gas asam sulfat ke dalam larutan arsenik (III) oksida. Reaksinya:
As203 (aq) + 3H2S (g) → As2S3 (s) + 3H20 (ℓ).
Koloid lain yang dihasilkan oleh reaksi transfer adalah sol sulfur. Sol ini dibuat dengan menambahkan solusi HCl ke solusi Na2S203. Campuran ini menciptakan partikel sulfur seukuran partikel koloid. Reaksi dalam produksi koloid sulfur adalah sebagai berikut.
Na 2 S 20 3 (aq) + 2HCI (aq) → 2 NaCl (aq) + H 2 SO 3 (aq) + S (s).
Reaksi redoks
Produksi koloid oleh reaksi redoks selalu disertai dengan perubahan bilangan oksidasi, misalnya dalam produksi emas dan sol sulfur.
- Sol emas (Au)
Sol emas dibuat dengan mengurangi larutan garam menggunakan zat pereduksi non-elektrolit seperti formaldehida.
Reaksi: 2AuCl 3 (aq) + 3HCHO (aq) + 3H20 (ℓ) → 2Au + 6HCI (aq) + 3HCOO H (aq) - Sol belerang
Sol belerang diproduksi dengan menyuntikkan gas H2S ke dalam larutan S02 atau ke dalam larutan H2O2. Reaksi yang terjadi:
2H2S (g) + SO2 (aq) → 3S (s) + 2H2O (ℓ)
H2S (g) + H202 (aq) → S (s) + 2h2O (ℓ)
Metode Fisika
Metode fisik digunakan untuk membuat koloid dengan mengkondensasi partikel koloid. Ini dilakukan sebagai berikut.
Kondensasi uap
Proses kondensasi uap digunakan dalam produksi sol merkuri (Hg). Sol merkuri dibuat dengan cara menguapkan merkuri. Uap merkuri kemudian dilewatkan melalui air dingin sehingga mengembun dan mengandung partikel koloid sebesar merkuri.
Pendinginan
Koloid dapat dibuat dengan proses pendinginan. Tujuannya adalah untuk menggumpalkan suatu larutan sehingga menjadi koloid, karena kelarutan suatu zat sebanding dengan suhu.
Penggantian pelarut
Penggantian pelarut digunakan untuk memfasilitasi produksi koloid yang tidak dapat larut dalam pelarut tertentu, misalnya dalam pembuatan sol belerang. Belerang sulit larut dalam air.
Karena itu, air diganti dengan alkohol. Sol belerang dalam air dibuat dengan melarutkan sulfur dalam alkohol untuk mendapatkan larutan jenuh. Larutan jenuh ini kemudian secara bertahap jatuh ke air untuk membentuk sol belerang.
Jalur Propagasi
Dispersi adalah proses untuk memproduksi koloid dari suspensi. Persiapan koloid dengan dispersi dapat dilakukan dengan menggunakan busur Bredig, mekanik, peptisasi dan homogenisasi
Jalan Busur Bredig
Produksi koloid menggunakan busur Bredig sering disebut elektrodispersi. Proses ini dilakukan untuk menghasilkan partikel fase terdispersi menggunakan percikan listrik.
Metode ini sering digunakan untuk memproduksi sol logam. Logam yang akan didispersikan dipasang sebagai elektroda yang terhubung ke sumber daya listrik bertegangan tinggi.
Percikan listrik yang terjadi di antara dua elektroda menguap beberapa logam. Uap logam yang terbentuk dalam medium dispersi menyublim dan membentuk partikel-partikel halus. Metode lengkung Bredig umumnya digunakan untuk memproduksi sol emas dan platinum.
Cara mekanis
Produksi koloid dengan cara mekanis terjadi dengan menggiling padat sampai halus dan kemudian menyebar dalam media pendispersi.
Dengan metode ini, bagaimanapun, fase terdispersi kadang-kadang menggumpal, sehingga stabilizer atau stabilizer harus ditambahkan. Contoh produksi mentega, tinta dan warna.
Metode peptizing
Peptisasi adalah cara menghasilkan koloid dengan memecah partikel zat yang mengendap dalam media pendispersi air menjadi ukuran partikel koloid.
Proses ini diikuti oleh penambahan elektrolit atau penghilangan elektrolit yang menyebabkan pengendapan.
Metode peptisasi ini digunakan untuk produksi sol perak iodida (AGL). Sol iodida perak dibuat dengan mencampurkan larutan AgNO3 dengan larutan Kl berlebih.
Mencampur dua solusi ini menghasilkan endapan Agl. Endapan Agl kemudian dicuci untuk menjalani peptisasi, yaitu pembentukan partikel Agl koloid. Mencuci menyebabkan hilangnya elektrolit berlebih, sehingga Agl dapat disebarkan kembali.
Metode homogenisasi
Homogenisasi adalah suatu proses di mana suatu zat dibuat homogen dan partikel koloid. Misalnya, untuk membuat emulsi jenis koloid seperti susu.
Saat memproduksi susu, ukuran partikel lemak dalam susu dikurangi menjadi ukuran partikel koloid. Anda melakukan ini dengan melewatkan zat melalui lubang berpori di bawah tekanan tinggi.
Jika partikel lemak dengan ukuran partikel koloid telah terbentuk, zat tersebut terdispersi dalam medium pendispersinya.
Jenis Dan Sistem Koloid
Sistem koloid dapat dikelompokkan sesuai dengan fase terdispersi dan fase pendispersi. Ada tiga jenis koloid berdasarkan fase terdispersi, termasuk sol (fase terdispersi padat), emulsi (fase terdispersi cair) dan busa (fase terdispersi gas). Koloid dengan fase dispersi gas disebut aerosol.
Berdasarkan fase terdispersi dan terdispersi, tipe koloid dapat dibagi menjadi 8 kelompok seperti yang ditunjukkan pada tabel di bawah ini.
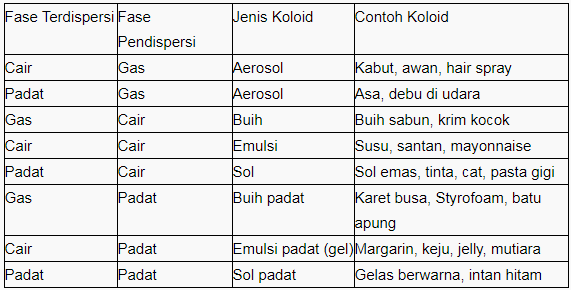
Sifat koloid
Efek Tyndall
Ketika seberkas cahaya diarahkan pada solusi, cahaya berlanjut. Namun, ketika sinar diarahkan pada sistem koloid, cahaya tersebar. Efek hamburan cahaya dari partikel koloid disebut efek Tyndall.
Efek Tyndall dapat digunakan untuk membedakan sistem koloid dari solusi. Hamburan cahaya ini terjadi karena ukuran partikel koloid hampir sesuai dengan panjang gelombang cahaya tampak (400 – 750 nm).
Gerakan Brown
Secara mikroskopis, partikel koloid secara acak bergerak dalam medium pendispersi pada jalur rusak (zigzag). Gerakan ini disebabkan oleh tabrakan antara partikel koloid dan medium pendispersi.
Gerak partikel acak ini disebut gerak Brown. Gerakan Brown membantu untuk menstabilkan partikel koloid sehingga tidak ada pemisahan antara partikel yang tersebar dan partikel tersebar karena pengaruh gravitasi.
Bagian koloid
Adsorpsi
Partikel koloid dapat menyerap partikel bermuatan dan tidak bermuatan lainnya di permukaan. Peristiwa penyerapan partikel pada permukaan zat ini disebut adsorpsi.
Partikel koloid dapat mengadsorpsi ion dari media pendispersinya sehingga bermuatan listrik. Jenis muatan tergantung pada muatan ion yang diserap.
Sebagai contoh, Sol Fe (OH) 3 bermuatan positif dalam air karena mengadsorpsi ion positif, sedangkan sol As2S3 bermuatan negatif karena mengadsorpsi ion negatif.
Elektroforesis
Partikel koloid dapat bergerak di medan listrik. Ini menunjukkan bahwa partikel koloid bermuatan listrik.
Pergerakan partikel koloid di medan listrik, di mana partikel bermuatan bergerak ke elektroda dengan muatan berlawanan, disebut elektroforesis.
Koloid bermuatan positif bergerak menuju elektroda negatif, sedangkan koloid bermuatan negatif bergerak ke arah elektroda positif.
Pembekuan
Muatan listrik yang sama dari partikel koloid membantu menstabilkan sistem koloid. Ketika muatan listrik hilang, partikel koloid menjadi tidak stabil dan membentuk rumpun bersama.
Proses pembentukan gumpalan partikel ini disebut koagulasi. Setelah benjolan ini tumbuh cukup besar, benjolan ini akhirnya mengendap karena gravitasi. Koagulasi dapat dilakukan dengan empat cara:
- secara mekanis, yaitu dengan mengaduk, memanaskan atau mendinginkan;
- menggunakan prinsip elektroforesis di mana partikel koloid yang bermuatan negatif diaglomerasi dalam elektroda positif dan partikel koloid yang bermuatan positif dalam elektroda negatif diaglomerasi ketika arus listrik mengalir cukup lama;
- Menambahkan elektrolit, dimana ion positif diambil dari elektrolit yang bermuatan negatif partikel koloid dan ion negatif dari elektrolit bermuatan positif partikel koloid, sehingga partikel koloid dikelilingi oleh lapisan kedua, yang muatannya berlawanan dengan lapisan pertama. Jika jarak antara dua lapisan cukup dekat, muatan partikel koloid netral, sehingga koagulasi terjadi. Semakin besar muatan ion dari elektrolit, semakin cepat dan lebih efektif proses koagulasi.
- Tambahkan koloid lain dengan muatan berlawanan, kedua sistem koloid dengan muatan berlawanan menarik dan mengadsorpsi satu sama lain sehingga terjadi koagulasi.
Koagulasi dapat dicegah dengan menambahkan koloid pelindung, yaitu koloid yang menstabilkan partikel koloid yang terdispersi dengan membungkusnya sehingga tidak dapat bergabung menjadi rumpun.
Kata Penutup
Demikian Pembahasan kita pada kali ini di edmodo.id tentang Pembuatan Koloid. Nantikan Artikel Menaraik Lainya, tetap bersama kami. Terimaksih Semoga Membawa Manfaat.
“Wassalamualaikum Warahmatullahi Wabarakatuh”
Baca Juga:
